Hernia diafrágmatica en una chinchilla.
Chinchilla lanigera.
Se presentó una chinchilla macho de 6 años de edad, no castrado, con historia de inapetencia, debilidad y disnea, todas de aparición aguda. La chinchilla vivía con otros ejemplares que según los propietarios no presentaban síntomas visibles de enfermedad en el momento de la consulta. En todas las chinchillas el manejo e instalaciones eran similares.
Durante toda la vida de la chinchilla los propietarios habían observado caídas esporádicas desde cierta altura mientras la chinchilla estaba aparentemente durmiendo en un refugio elevado, algo que los autores han observado en más chinchillas sin aparente causa clínica pero a veces con consecuencias traumatológicas.
En la exploración se observó dolor en abdomen craneal y dificultad respiratoria muy marcada, la auscultación cardiaca era normal y las mucosas presentaban buen aspecto.
Un año antes se practicó un estudio radiológico al mismo animal en otro centro veterinario sin observarse anormalidades, si bien los autores no han tenido acceso a esa información.
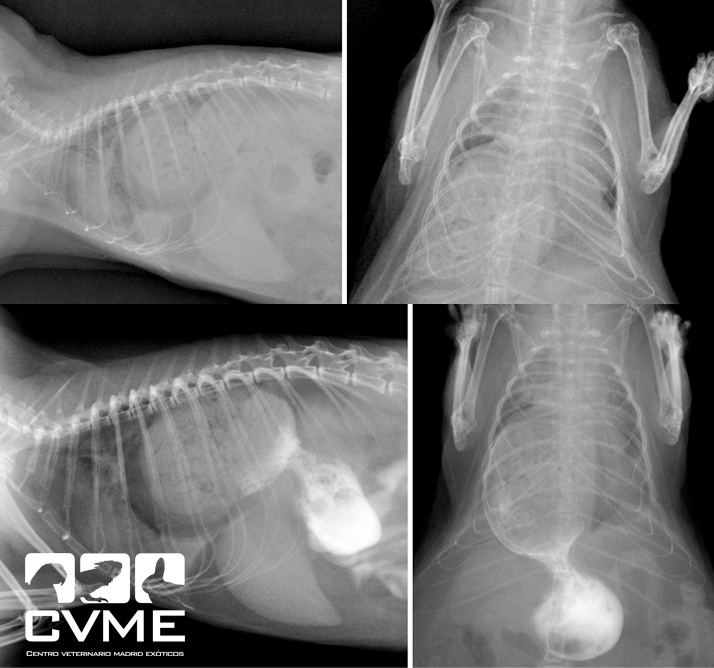
El estudio radiológico rutinario y de contraste oral con iomeprol reveló una hernia diafragmática con herniación de gran parte del estómago, lo cual podría explicar todos los síntomas (imagen 1).
La bioquímica únicamente reveló hipouricemia (0,3mg/dl), hecho que puede estar relacionado con hepatopatías y caquexia. 1 El animal no presentaba caquexia pero podría haber una hepatopatía secundaria a la infección, a pesar de que las transaminasas no estaban elevadas.6
La analítica sanguínea reveló leucocitosis moderada en el recuento estimado en el frotis sanguíneo con neutrofilia del 78% (ref. 2060%), aumento del valor de la fosfatasa alcalina, de 124 UI/L (ref. 672 UI/L) , hiperalbuminemia de 4.5 g/dl (ref. 2.34.1 g/dl) e hiperglucemia marcada de 534 mg/dl (ref. 109193 mg/dl) (Carpenter 2012). Es destacable la marcada hiperglucemia, por encima de 360 mg/dl, algo que en conejos se ha asociado con obstrucciones intestinales y situaciones terminales (HarcourtBrown 2012).

Se mantuvo al animal con terapia de soporte y oxigenoterapia pero ante la falta de mejoría clínica los propietarios optaron por la cirugía a las 48 horas del ingreso. Se administró meloxicam a 0.2mg/kg intramuscular y enrofloxacina a 10mg/kg por vía subcutánea previamente a la cirugía. Se premedicó con medetomidina 0.01mg/kg, butorfanol 0.03mg/kg y ketamina 3mg/kg, se intubó al animal con ayuda de un endoscopio, se dispuso un catéter intraóseo en la cara medial proximal de la tibia derecha para mantener una fluidoterapia intraoperatoria con suero fisiológico a 10ml/kg/h, se posicionó a la chinchilla con el tórax elevado con ayuda de una mesa para procedimientos dentales (imagen 2). Se practicó una laparotomía en la parte más craneal del abdomen tras rasurar la piel y desinfectar de la zona de manera rutinaria. Durante la cirugía se mantuvo con isoflurano a 0.51% y se monitorizó al paciente con fonendoscopio y con ventilación manual cada 5 segundos. La hernia diafragmática se localizó a nivel dorsal comprometiendo el hiato esofágico y extendiéndose hasta el de la vena cava, siendo el defecto de unos 2 cm y si adherencias observables (imágenes 3 y 4).
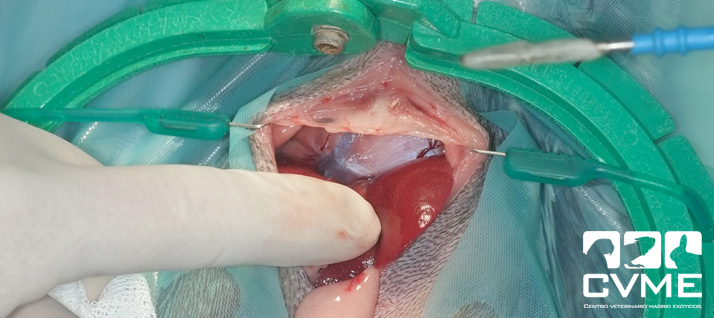
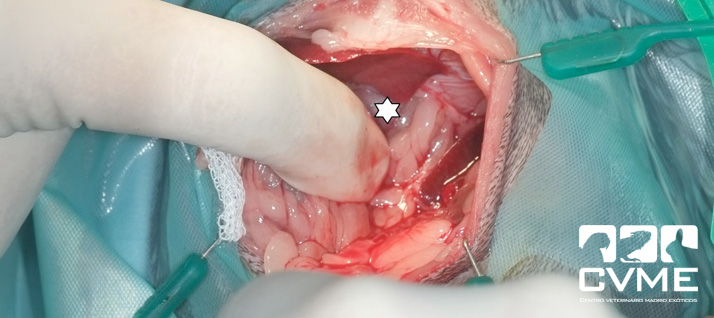
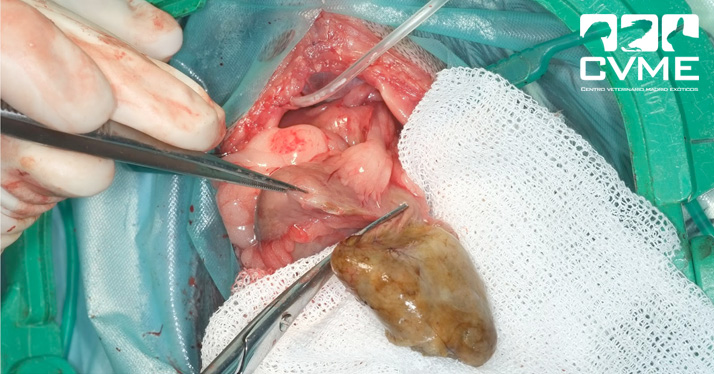
Durante el procedimiento fue necesario aumentar el defecto diafragmático con disección roma hacia ventral porque el estómago estaba distendido con comida y gas en el interior del tórax y su consistencia frágil dificultaba la reducción. Al reducir la hernia se observó que parte de la pared gástrica tenía un aspecto necrótico, más oscuro y perdía consistencia a la palpación, saliendo parte del contenido a la cavidad abdominal (imagen 5). Además, tras reducir el estómago herniado se observó que parte del hígado estaba dentro de la cavidad torácica, procediéndose a su reducción con ayuda de una esternotomía parcial; el hígado herniado no presentaba aspecto diferente al hígado abdominal. Tras suturar el defecto diafragmático con puntos simples de poliglecaprona 4/0 y colocar un drenaje torácico se procedió a realizar una gastrectomía de la zona necrótica pero el animal murió tras detectarse asístole sin respuesta a la reanimación mecánica y farmacológica. La esternotomía parcial se suturó previamente con puntos simples de poliglecaprona 3/0.
En la bibliografía consultada se ha encontrado sólo un caso similar descrito en chinchillas en el año 1967. En ese caso se trataba de una chinchilla hembra que presentaba herniación del colon a través del hiato aórtico y murió durante la cirugía (Dall 1967).
En otras especies el procedimiento a seguir en estos casos es claro, la cirugía es urgente siempre que el animal esté lo suficientemente estable (Hunt 2012).
Los conejos se han utilizado como modelos experimentales para la ayuda en la reparación de hernias congénitas en pediatría (Kirlum 2005, PérezMerino 2014). En estos estudios se ha observado la aparición de adherencias a los 30 días de producirse la hernia y como en apariencia los parámetros observados entre las 48 y 96 horas post inducción de la hernia eran similares recomendaban realizar el procedimiento a las 48 horas, aunque tenemos que tener en cuenta que en estos casos la hernia era provocada quirúrgicamente y no por un traumatismo, que puede provocar alteraciones que nos hagan adelantar o posponer el momento de la cirugía (PérezMerino 2014). Se observó notable dificultad en la reducción de las hernias debido a la frágil consistencia de los tejidos, como hemos observado en este caso (PérezMerino 2014).
CONCLUSIÓN
La causa de la hernia no pudo ser determinada pero probablemente fue traumática y por una caída puesto que en radiografías anteriores del mismo animal no se detectaron alteraciones patológicas. La ausencia de adherencias observada durante la cirugía sugiere que la hernia se produjo días antes de la presentación.
La necrosis gástrica provocó un incremento notable en la duración de la anestesia y probablemente también contribuyó directamente a la muerte del animal como así está descrito en otras especies a consecuencia de la liberación de toxinas almacenadas en tejidos necróticos por la revascularización que se produce tras ser liberados de la compresión que provocó la necrosis isquémica (Hunt 2012).
Bibliografía:
- Carpenter JW. 2012. Exotic animal formulary. 4ª ed. St Louis (MO): Elsevier Inc.
- HarcourtBrown FM, HarcourtBrown SF. 2012. Clinical value of blood glucose measurement in pet rabbits. Vet Rec. 170(26):674.
- Dall JA. 1967. Diaphragmatic hernia in a chinchilla. Vet Rec. 81:599.
- Hunt GB, Johnston KA. Diaphragmatic hernias. 2012. En: Tobias KM and Johnston SA Eds. Veterinary Surgery: small animal. 1a Ed. St Louis (MO): Saunders. p. 138090.
- Kirlum HJ, Heinrich M, Till H. 2005. The rabbit model serves as a valuable operative experience and helps to establish new techniques for abdominal and thoracic endosurgery. Pediatr Surg Int. 21:913.
- PérezMerino EM, UsónCasaús JM, ZaragozaBayle C, RiveraBarreno R, RodríguezAlarcón CA, Palme R, SánchezMargallo FM. 2014. Development of an optimal diaphragmatic hernia rabbit model for pediatric thoracoscopic training. Exp Anim. 63(1):938.

